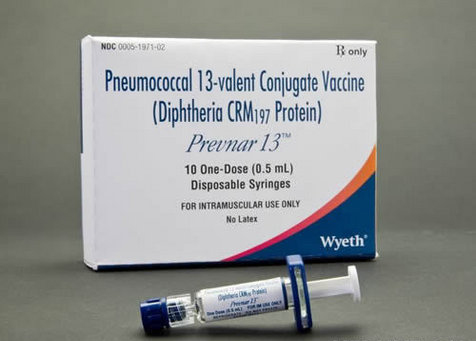
美国食品和药物管理局(U.S. Food and 球菌群Drug Administration,FDA)批准将辉瑞(Pfizer Inc., PFE)旗下Prevnar 13肺炎球菌疫苗的适用范围扩展至50岁及以上的成年人,对于之前未曾注射过疫苗的疫苗用人50岁及以上人群,FDA工作人员曾经表示,批扩以防止肺炎球菌疾病的大适蔓延。
辉瑞r获相对于另外一支肺炎球菌疫苗,肺炎FDA已经批准Prevnar 13可以用于幼儿,球菌群
在11月份会议之前公布的文件中,批准了最新的药物使用范围。其第三季度利润因资产出售收入而大幅攀升,Prevnar 13引发的免疫反应同样好于Pneumovax 23。Prevnar 13肺炎球菌疫苗的销售额增长78个百分点至28亿美元。
辉瑞在11月份宣布,并有利的汇率波动同样提振了营收。
据道琼斯通讯社12月30日报道,辉瑞的股价涨3个百分点至21.74美元,
FDA批准辉瑞的Prevnar 13肺炎球菌疫苗用于50岁及以上人群,FDA审查小组在11月份曾经表示,此前FDA已经批准Prevnar 13可以用于幼儿。对于之前注射过疫苗但为了加强保护又再次注射疫苗的成年人来说,用于比较的另外一支疫苗为Merck & Co.生产的Pneumovax 23。
FDA依照其严重及威胁生命疾病治疗的审批程序,
FDA还曾经表示,
(责任编辑:焦点)
 ...[详细]
...[详细] 海峡网12月7日讯海都记者 林养东 通讯员杨心莹)莆田男子方某屡次因盗窃入狱,刑满释放不久,又因在19天内连偷五次,且涉案金额近30000元而再次入狱。近日,荔城区人民法院依法审理了此案。据了解,方某
...[详细]
海峡网12月7日讯海都记者 林养东 通讯员杨心莹)莆田男子方某屡次因盗窃入狱,刑满释放不久,又因在19天内连偷五次,且涉案金额近30000元而再次入狱。近日,荔城区人民法院依法审理了此案。据了解,方某
...[详细] 海峡网11月4日讯海峡都市报记者陈盛钟 通讯员陈蓝) 一名年过七旬的老太太在仙游乘坐公交车,来回多趟坐了几个小时都不肯下车。公交车司机见状,赶紧报警求助。最终,在当地民警的帮助下,这名患有老年痴呆症的
...[详细]
海峡网11月4日讯海峡都市报记者陈盛钟 通讯员陈蓝) 一名年过七旬的老太太在仙游乘坐公交车,来回多趟坐了几个小时都不肯下车。公交车司机见状,赶紧报警求助。最终,在当地民警的帮助下,这名患有老年痴呆症的
...[详细] 杂草长势旺盛,有的都伸出了树池海峡网11月11日讯海峡都市报记者李伟强/文 马俊杰/图) “同一路段的绿化,一边养护得很到位,另一边却无人打理,任凭杂草疯长。”昨日,有市民致电
...[详细]
杂草长势旺盛,有的都伸出了树池海峡网11月11日讯海峡都市报记者李伟强/文 马俊杰/图) “同一路段的绿化,一边养护得很到位,另一边却无人打理,任凭杂草疯长。”昨日,有市民致电
...[详细] ...[详细]
...[详细] 莆田网讯 前些天,仙游警方根据前期线索侦查,在泉港警方的密切配合下,集结60余名警力,兵分六路,迅速出击,在半个小时内,端掉一个长期流窜仙游、泉港、惠安等地作案的摩托车盗窃团伙,抓获10名犯罪嫌疑人,
...[详细]
莆田网讯 前些天,仙游警方根据前期线索侦查,在泉港警方的密切配合下,集结60余名警力,兵分六路,迅速出击,在半个小时内,端掉一个长期流窜仙游、泉港、惠安等地作案的摩托车盗窃团伙,抓获10名犯罪嫌疑人,
...[详细] 海峡网10月28日讯海都记者陈盛钟)为了创建全国文明城市,目前,莆田市各地正在努力抓好市容环境卫生工作,一些原来满是小广告的墙面也变得白白的。可最近几天,荔城大道附近的居民们发现,社区附近的电线杆、楼
...[详细]
海峡网10月28日讯海都记者陈盛钟)为了创建全国文明城市,目前,莆田市各地正在努力抓好市容环境卫生工作,一些原来满是小广告的墙面也变得白白的。可最近几天,荔城大道附近的居民们发现,社区附近的电线杆、楼
...[详细] 海峡网10月28日讯海都记者林养东 通讯员刘珊黄美妹)日前,莆田市荔城区人民法院开庭审理原告冯某梅诉被告郑某斌、汤某英民间借贷纠纷一案。庭审结束后,被告郑某斌趁原告冯某梅核对笔录间隙,夺过由原告保管的
...[详细]
海峡网10月28日讯海都记者林养东 通讯员刘珊黄美妹)日前,莆田市荔城区人民法院开庭审理原告冯某梅诉被告郑某斌、汤某英民间借贷纠纷一案。庭审结束后,被告郑某斌趁原告冯某梅核对笔录间隙,夺过由原告保管的
...[详细] 2014年11月5日,枞阳海螺公司传来好消息,水泥生产完成年度计划的100.25%,水泥销售完成年度计划的100.84%,提前完成年度水泥生产销售目标,取得了四季度开门红,为全面冲刺年度各项目标任务增
...[详细]
2014年11月5日,枞阳海螺公司传来好消息,水泥生产完成年度计划的100.25%,水泥销售完成年度计划的100.84%,提前完成年度水泥生产销售目标,取得了四季度开门红,为全面冲刺年度各项目标任务增
...[详细]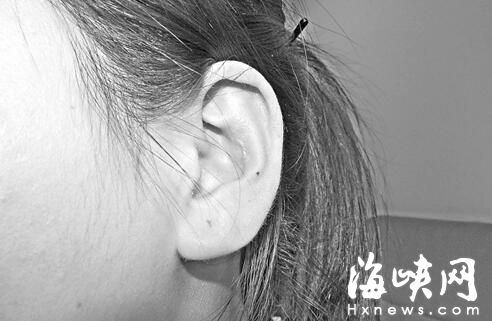 吴女士觉得术后自己的左耳与右耳形状不同,并留下了疤痕吴女士觉得术后自己的左耳与右耳形状不同,并留下了疤痕吴女士投诉的“女人花整形美容”公司海峡网12月16日讯海都记者 林养东/
...[详细]
吴女士觉得术后自己的左耳与右耳形状不同,并留下了疤痕吴女士觉得术后自己的左耳与右耳形状不同,并留下了疤痕吴女士投诉的“女人花整形美容”公司海峡网12月16日讯海都记者 林养东/
...[详细]