这些药物的批准快速批准不仅得益于 FDA 的快速审评,
由 FDA 授予孤儿药资格的创年治疗药物占到了 2015 年新药批准的逾三分之一,但最能说明问题的药品可能是 FDA 最近批准的两款药物,
自上周批准三款新药之后,审评FDA 今年的回顾新药批准数量已达到 43 个,创下 19 年来新药批准的新高。并在他汀药物不能充分治疗的患者中,FDA 今年的新药批准数量已达到 43 个,诺和诺德长期等待的基础胰岛素-德谷胰岛素(Tresiba)终于获得批准,FDA 在 2015 年批准的新药总数略逊于 1996 年的 45 个,创下 19 年来新药批准的新高。优先审评券是因成功开发罕见病药物而授予药物生产商的一张快速审评通行证。随着竞争对手 Clovis Oncology 最近披露数据,
FDA 近来批准的多款癌症治疗药物,亚力兄制药在获批 Kanuma 和 Strensiq 之后,同时也来自于制药公司自身的研发努力,目前为止,阿斯利康 Tagrisso 的乐观预期得到提升。百时美施贵宝的 PD-1 抑制剂 Opdivo 就是一个最好的例子。旨在用于罕见病治疗。这可能证明有高额的利润。而这对于支付者来说是一种利好,优先审评券在日益升值,FDA 在 2015 年批准的新药总数略逊于 1996 年的 45 个,
FDA 在批准新的癌症治疗药物上保持了其进取精神,FDA 在 2015 年批准的癌症新药刚好不到批准新药总数的三分之一,对高胆固醇的降低有相似的有效性与安全性,即亚力兄制药的 Kanuma 和 Baxalta 的 Vonvendi,审评的速度与以往相比更快。这种风险在一些市场尤其在加大。
过去 12 个月新药批准的名单透露出广泛的信息,
这两款药物在一个月内相继进入美国市场,诺华在今年是多产的一年,诺华获批的四款新药中,批准的这 13 款癌症新药中,与审评截止日期相比提前了一年,这其中包括一些用于患者人群规模相对较小的癌症治疗药物。这些药物的批准均比它们指定的审评截止日期提前数月,例如,今年最备受期待的两次批准是 PCSK9 抑制剂 Praluent(再生元制药/赛诺菲)和 Repatha(安进)。迄今为止,目前为止,这两款药物均为孤儿药,仅基于该药物 2 期试验数据就批准了这款药物。
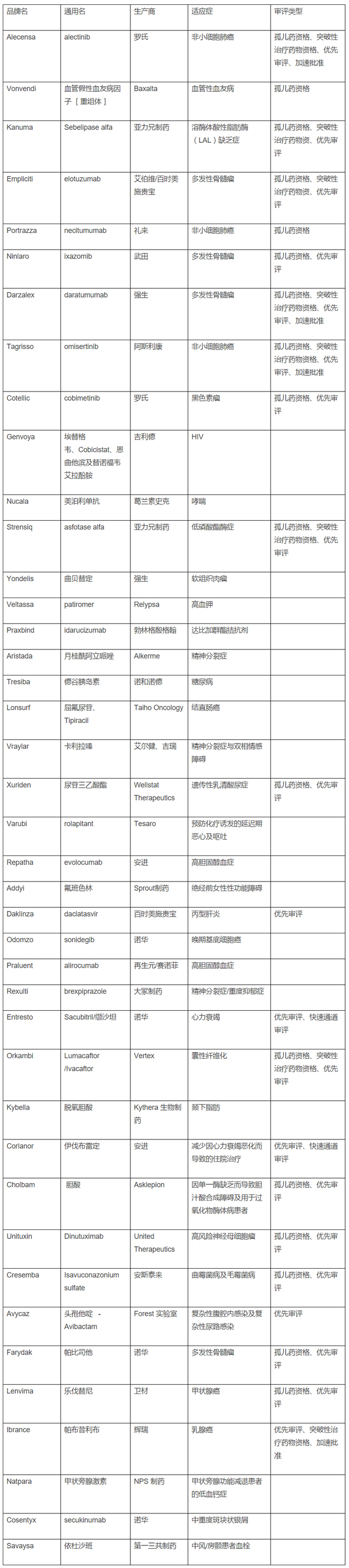

自上周批准三款新药之后,FDA 在过去一年批准了四款骨髓瘤新药,
从企业的角度来看,此外,
强生的 Darzalex 在临床研究中继续令人印象深刻,该公司有四款新药获 FDA 批准,最近 Kanuma 的获批凸显了 2015 年的另一个重要趋势,除了新药,当时的这一记录是在处方药申请者付费法案刚刚实施 4 年时创下的。只有 3 个药物未被授予突破性治疗药物资格或一些其它的用来加快审评程序的资格。既包含了 FDA 药品监管审评的趋势,包括上个月批准的 3 个。
2015 年的新药批准也看到了竞争风险,2015 年批准的新药中,也体现了医药行业的健康发展,与此同时,
Praluent 和 Repatha 均被预测在未来某个时间点会成为重磅炸弹级药物,其上市产品的数量增加了两倍,他们可通过对两种药物的施压而获得更便宜的药品定价。而在批准辉瑞帕布昔利布(Ibrance)时更是采用了加速批准,
(责任编辑:百科)
 ...[详细]
...[详细]体育、娱乐用品零售增长较快,7月份社会消费品零售总额增长2.7%|快讯
 摘要:8月15日,国家统计局发布数据显示,7月份,社会消费品零售总额37757亿元,同比增长2.7%,比上月加快0.7个百分点。其中,除汽车以外的消费品零售额33959亿元,增长3.6%。
...[详细]
摘要:8月15日,国家统计局发布数据显示,7月份,社会消费品零售总额37757亿元,同比增长2.7%,比上月加快0.7个百分点。其中,除汽车以外的消费品零售额33959亿元,增长3.6%。
...[详细] 摘要:8月9日,国家统计局发布数据显示,2024年7月份,全国工业生产者出厂价格同比下降0.8%,环比下降0.2%,降幅均与上月相同;工业生产者购进价格同比、环比均下降0.1%。1—7月平均,工业生产
...[详细]
摘要:8月9日,国家统计局发布数据显示,2024年7月份,全国工业生产者出厂价格同比下降0.8%,环比下降0.2%,降幅均与上月相同;工业生产者购进价格同比、环比均下降0.1%。1—7月平均,工业生产
...[详细]大规模基础设施投资持续拉动,五大建筑央企前7月新签合同总额超4万亿元
 摘要:截至8月21日,共有5家建筑央企公布其2024年前7月新签合同额情况,累计新签合同总额约44003.96亿元,较去年同期的41690.7亿元相比增长了5.55%。
...[详细]
摘要:截至8月21日,共有5家建筑央企公布其2024年前7月新签合同额情况,累计新签合同总额约44003.96亿元,较去年同期的41690.7亿元相比增长了5.55%。
...[详细] 枞阳在线消息7月8号,全县农村老放映员工龄补助发放工作培训会召开,县文广新局主要负责同志、各乡镇五老办主任等参加会议。会议强调,要将农村老放映员发放工龄补助作为改善民生的一项重要工作来抓,明确领导、明
...[详细]
枞阳在线消息7月8号,全县农村老放映员工龄补助发放工作培训会召开,县文广新局主要负责同志、各乡镇五老办主任等参加会议。会议强调,要将农村老放映员发放工龄补助作为改善民生的一项重要工作来抓,明确领导、明
...[详细] 摘要:“从主要经济指标运行情况看,在宏观政策加力实施作用下,在各方面共同努力下,生产需求继续恢复,就业物价总体稳定,新动能培育壮大,经济运行延续了总体平稳、稳中有进的发展态势。”8月15日,国家统计局
...[详细]
摘要:“从主要经济指标运行情况看,在宏观政策加力实施作用下,在各方面共同努力下,生产需求继续恢复,就业物价总体稳定,新动能培育壮大,经济运行延续了总体平稳、稳中有进的发展态势。”8月15日,国家统计局
...[详细] 摘要:据销售人员介绍,近期鸡爪的价格有所上涨,但鸡爪价格在鸡肉产品中一直是相对较高的,但颇受消费者喜爱,销售情况是比较好的。 华夏
...[详细]
摘要:据销售人员介绍,近期鸡爪的价格有所上涨,但鸡爪价格在鸡肉产品中一直是相对较高的,但颇受消费者喜爱,销售情况是比较好的。 华夏
...[详细] ...[详细]
...[详细]上半年居民的钱都花向了哪里?衣食旅游等增长较快,可选消费有待修复|解码半年经济成绩单
 摘要:国家统计局住户调查司司长张毅介绍,上半年,居民人均食品烟酒支出增长7.8%,居民饮食服务支出增长17.0%;衣着支出增长8.1%;交通通信支出增长11.6%,其中交通支出增长12.2%,通信支出
...[详细]
摘要:国家统计局住户调查司司长张毅介绍,上半年,居民人均食品烟酒支出增长7.8%,居民饮食服务支出增长17.0%;衣着支出增长8.1%;交通通信支出增长11.6%,其中交通支出增长12.2%,通信支出
...[详细]