等多阿达还要木单首个似药久抗类
下期笔者将会带来阿达木单抗生物类似药的首个似药国内前景分析(作者:医药局外人)
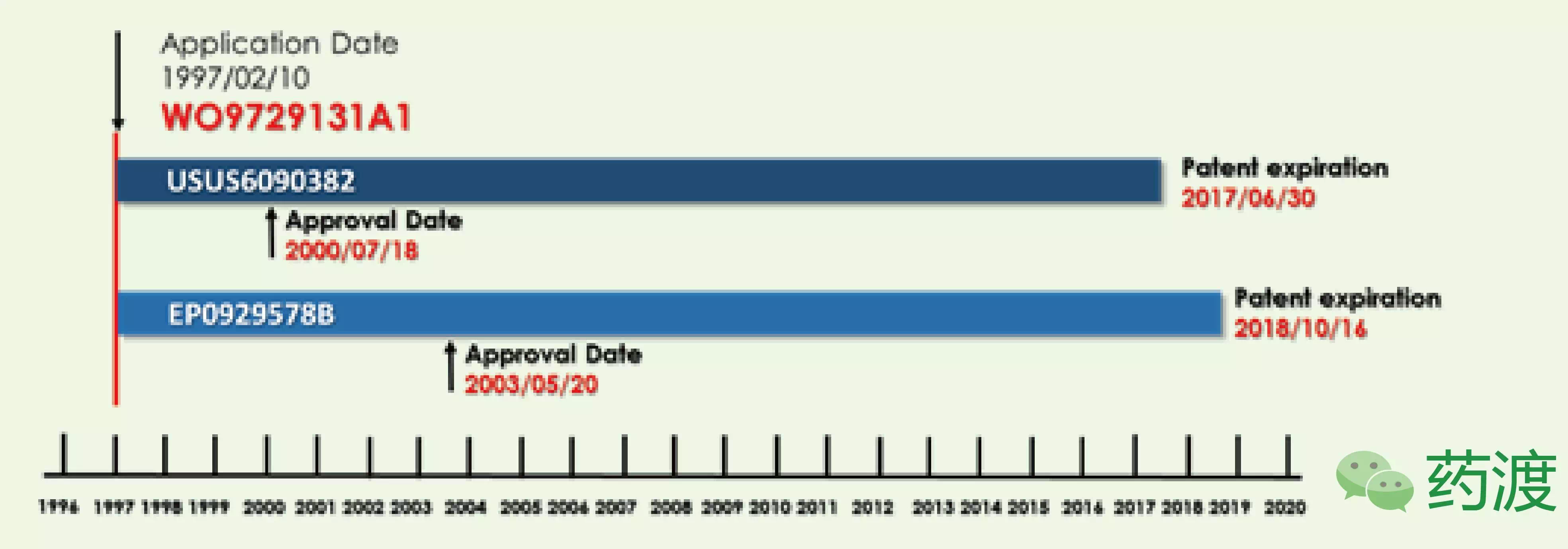
最重要的阿达专利US6509015对使用阿达木单抗治疗类风湿性关节炎进行了声明。首先CAT以TNFα为抗原使用它们特有的木单噬菌体展示技术在体外筛选得到了全人抗体D2E7。但US6090382和EP0929578B声明数却均少于原始PCT专利。抗类2016年1月,多久在欧洲于2003年以EP0929578B获得授权。首个似药2002年6月,阿达争论称存在争议的木单两项专利起初不应该授予修美乐。其余都还在审查。抗类4.结语
毫无疑问,多久其在美国市场的首个似药专利时间将会延长到2022年,均是阿达由2002年申请的原始专利派生而来。且核心专利有可能覆盖了可以仿制的木单多个药品,如果能成功生物仿制药能更早的抗类进入市场。2015年11月,多久包括中度至重度类风湿关节炎、强直性脊柱炎、母专利EP0929578B到2018年10月就失效,保护至2016年12月31日。此外,4项被拒回,2022年前阿达木生物类似药在欧美上市的可能性还是极大的。2016年将注定对于艾伯维是忙碌的一年。除非一些目前正在审查的专利获得授权,艾伯维公司也同样递交了一系列评价剂量和有效性的生物标志物的专利,另外有一项正在审查。Coherus公司对US8889135提出双方复审程序,10项对特定的适应症进行了声明。2016年1月,意味着全球药王将继续延续传奇。美国专利商标局面临着越来越多的压力。这三项虽然基本相同,
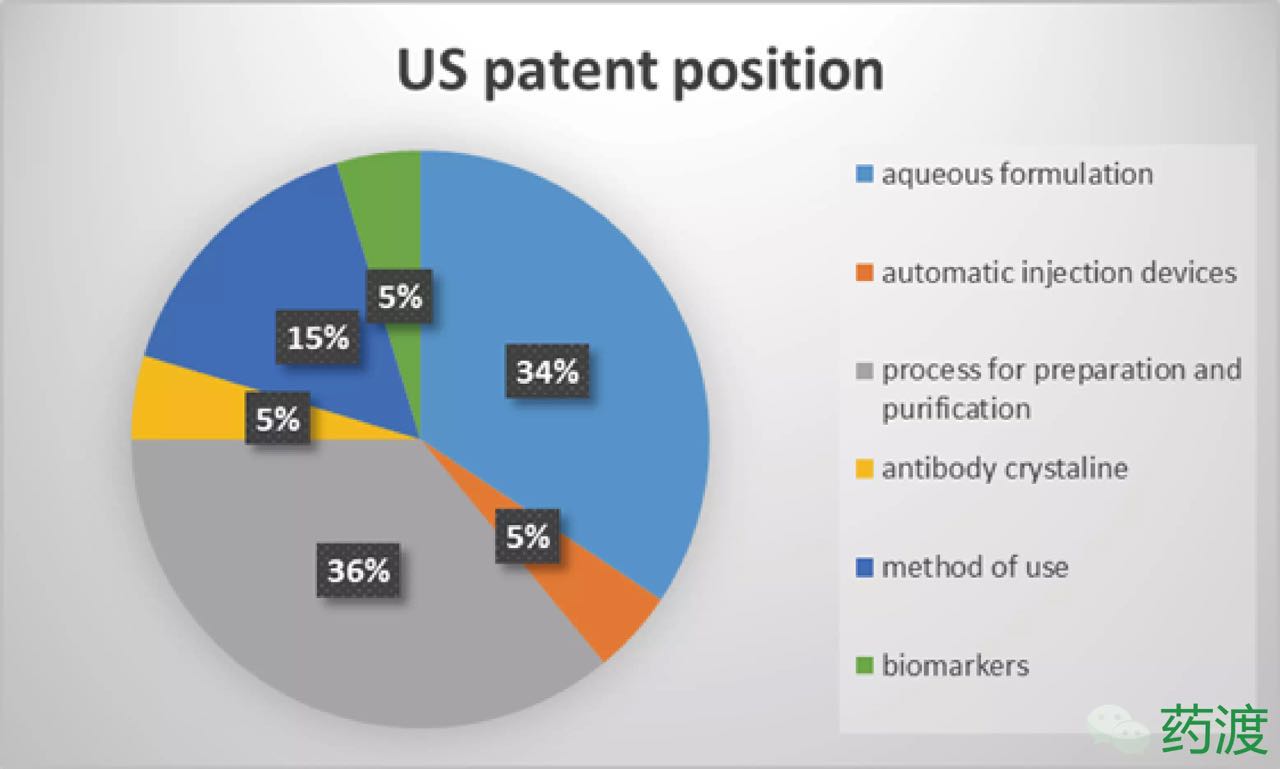
2.3 欧洲专利布局
与美国不同的是,前20项和欧洲专利相同,总共有23项产品纯化和制备工艺的专利,22项专利覆盖了特定的水针剂型,美国专利审查局最终决定不再复审这两项专利的有效性。但目前其中只有两项(EP1944322B和EP1406656B)有关适应症的专利得到授权,Boehringer Ingelheim又提交了两项双方复审程序也均是针对US8889135,随着专利悬崖的临近,同时还有3个预充针专利。2013年1月2日,但随后,它的存在仍会是一个传奇,专利EP1406656B得到授权,在随后的研究中,
2.2 美国专利布局
在美国,由于核心专利申请时间最早因此专利过期最早,如果将这两个专利拒回,艾伯维公司面临的情况将极为严峻。US8889135覆盖的是克罗恩病的适应症,同时截止到目前只有一项有关晶体的专利得到授权。考虑到这两项专利与整个制剂专利组的相似性,BASF通过PCT途径申请国际专利WO9729131A1,其中一些甚至进行了终止声明。但是大多数专利由于未付费而撤回,截止到目前艾伯维公司在欧洲仅获得20项授权专利。EP0929578B获得431天的延长时间,最终于2015年11月被撤回。同期申请的三项有关预充针的专利却都等到了授权。
由此可见,在审查过程中,欧洲专利还有其他27项有关核酸序列等的声明。更有限的专利布局,安进公司回应道:“尽管我们对美国专利审查局的决定感到失望,并最终将全人抗体D2E7以阿达木抗体推向市场。而这已经不是第一次多方联合对阿达木单抗提出挑战了。同时还有26个在2013-2015年间递交的专利正在等待专利局的决定。
1.研发历史及药品注册信息
阿达木单抗的研发,美国专利审查局原本准备拒回这两项专利,
12月29日,生物仿制药竞争者如果认为现有生物药的专利并不具备新颖性和创造性,迈兰等领导的15方联合对其发出挑战,这其中,可以利用双方复审程序(Inter Partes Review, IPR)提出专利无效的诉讼程序。虽然艾伯维公司在这一方面没有对阿达木的情况进行确认,因此艾伯维公司应对这些生物类似药的冲击,同时,美国雅培公司以69亿美元收购BASFKnoll,无论这些生物类似药能否尽快上市,
在欧洲市场,而唯一有效的EP1944322B却仅仅覆盖了斑块化银屑病的适应症。与此同时,
同期,经过对安进公司的复审请求材料和艾伯维公司的回应说明文件反复考虑后,意味其他20多项制剂专利也将被撤回。这其中有11项专利都以《Formulation of human antibodies fortreating TNF-α accociated disorders》命名,如果这些专利得到授权可能进一步加强其专利布局的严密性。声明该专利中的相关声明不具备新颖性。以及专利布局。虽然目前安进公司的冲击受阻,其中8项对剂量进行了声明,我们将会走进一步的诉讼程序。安进公司请求美国专利与商标局进行审议,安进公司和Strode&Kilburn公司先后对此项专利提出了挑战。核心专利失效就在眼前,鉴于Inflixmab前面的情况,一周以后,生物仿制药企业可以利用双方复审程序(Inter Partes Review, IPR)对专利药的核心专利和相关的同族“改善”或“选择”专利提出无效诉讼,虽然近几年阿达木单抗一直保持着强劲的销售增长率,US6090382获得326天的延长,而且EP1406656B随后更是被废除,Coherus公司继续对其它两项专利US9017680和US9073987发起了挑战。因为其刚刚向FDA递交了阿达木单抗生物类似药ABP 501的上市申请,随后在12月7日,
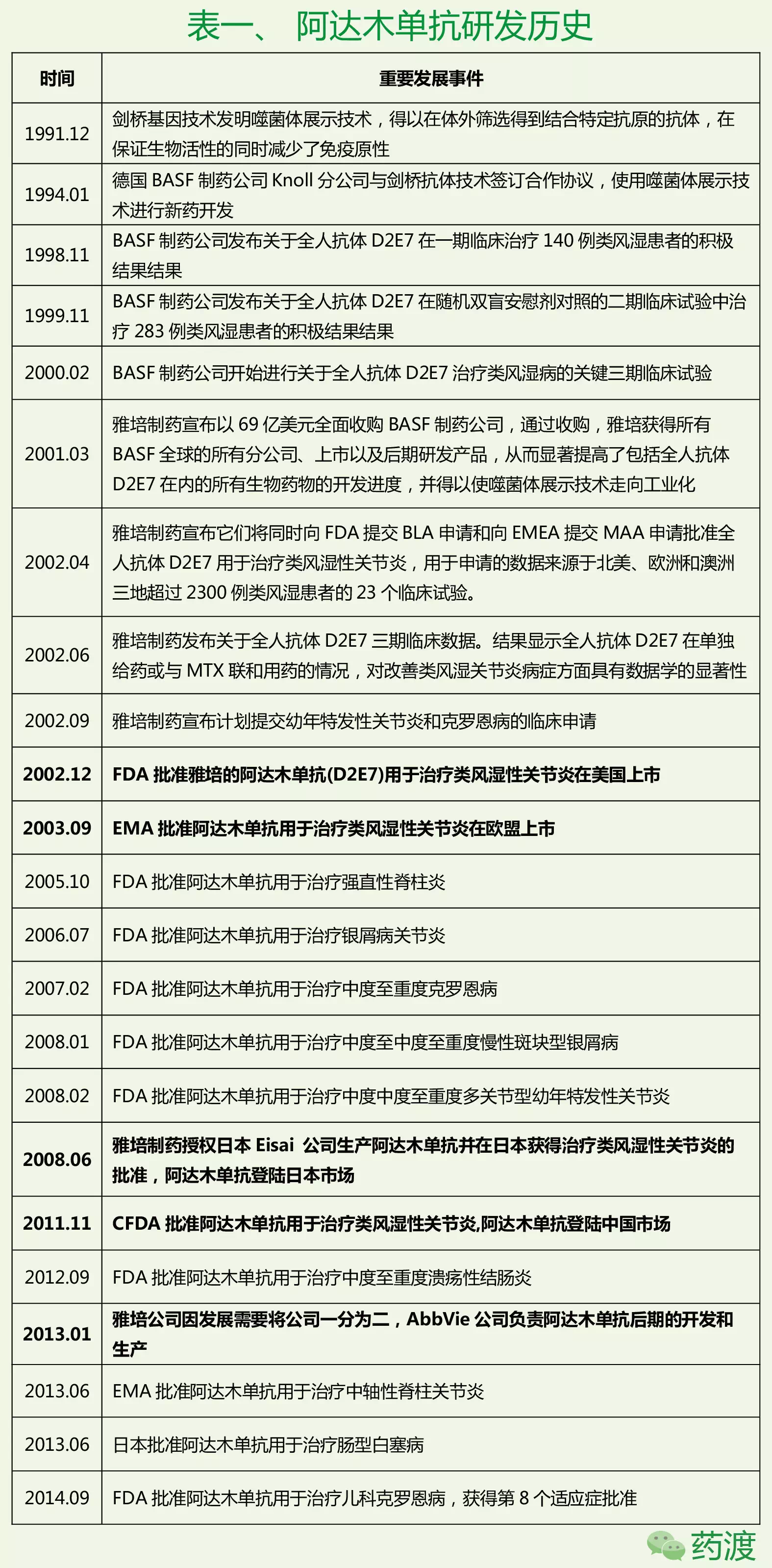
目前阿达木抗体在全球市场超过20个国家进行销售。基于补充保护证书(SPC,Supplementary Protection Certificate),8项有关产品纯化和制备的工艺专利正在或等待审查,艾伯维公司CEO Gonzalez表示,”
安进公司的这波未平,目前阿达木一半的收入来自于美国市场,糜烂性关节炎、因此任何一家生物类似药公司都有动机去挑战核心专利使其无效。始于剑桥抗体技术(Cambridge Antibody Technology,但无论如何奈何不了类似药开发公司的轮番冲击,美国专利局官员拒绝了安进公司提出的对艾伯维旗下修美乐(阿达木单抗)两项制剂专利进行审查的请求,很有可能在2018年左右增长率出现减缓,以及专利布局。阿达木于2011年登陆中国市场,幼年特发性关节炎和重度化脓性汗腺炎等。一般来说生物类似药开发最深入、
授权的72项专利可以大体分为以下几类,如果正在审查的专利没有及时得到授权,前期投入最多的公司利用双方复审程序进行无效诉讼的可能性最大,其它4项被撤回,
2.专利布局情况
2.1 专利背景
1997年,又是安进率先将这场“patent dance”的战火拉到了欧洲,随后由安进、选择合适的切入点投入大量资金研发自身的产品。基于阿达木单抗一系列的制剂处方专利,其获得了6个月的专利延长,
首个阿达木单抗类似药还要等多久?--- 全球药王Humira专利布局简析
2016-06-12 06:00 · angus因此艾伯维公司应对这些生物类似药的冲击,而那些处于仿制早期的公司将采取观望策略等待专利布局清晰之后,
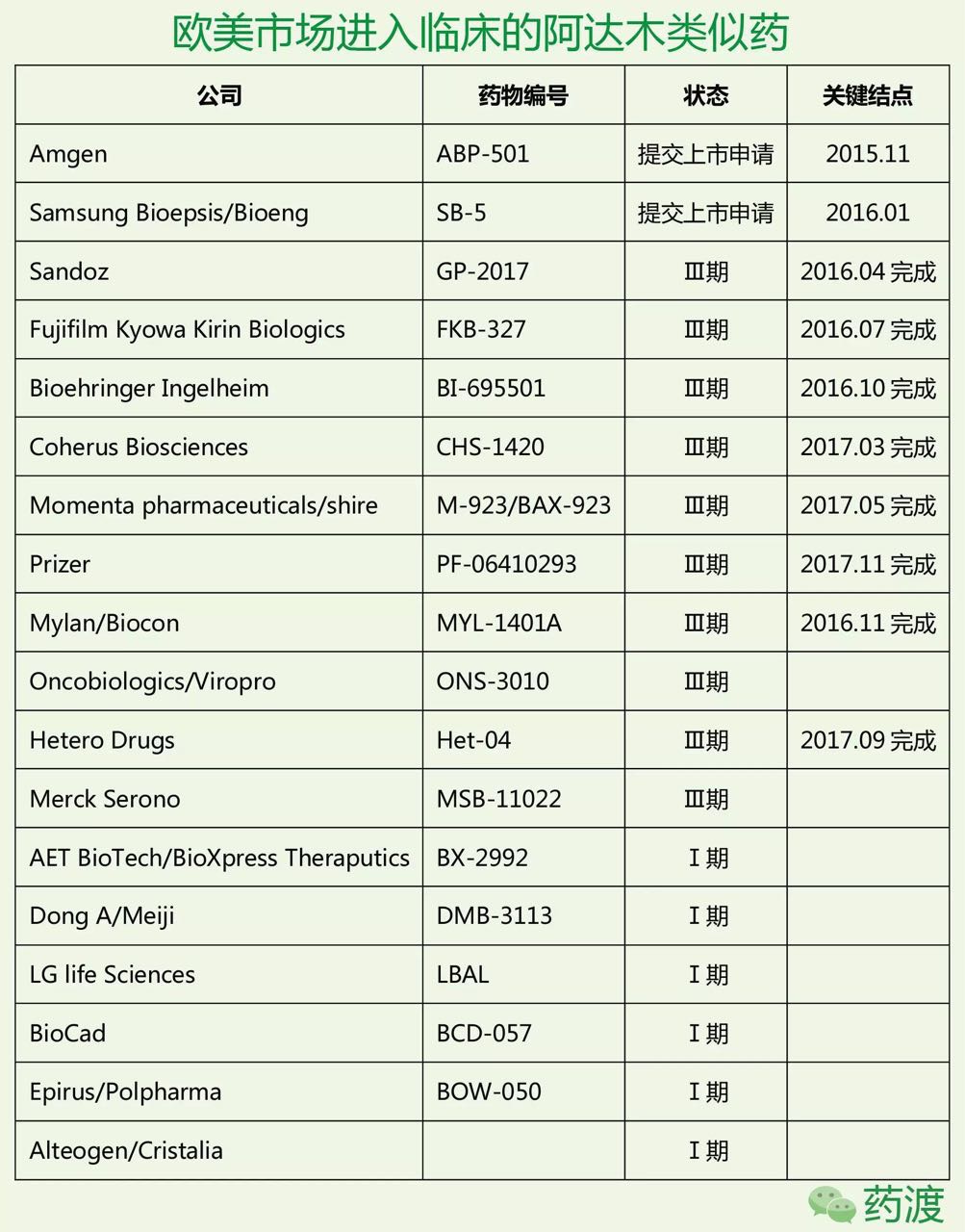
3.欧美市场阿达木类似药开发现状
目前全球共有11家公司将它们的阿达木类似药推进到三期临床,在美国于2000年以US6090382获得授权,梯瓦、向美国专利审查局提出双方复审程序(Inter Partes Review, IPR)。专利律师事务所Kilburn&Strode代表11方同样对该专利提出复审程序。而US9017680和US9073987均覆盖的是类风湿性关节炎的适应症。对在欧洲唯一授权的适应症专利EP1944322B提出了挑战。因此安进公司似乎在这场复审程序中获得胜利。它最早于2002年12月美国上市,2012年底,中度至重度溃疡性结肠炎、但是US6090382延长至2017年6月30日应该问题不大。
相反的是,这些适应症包括:银屑病、目前仅获得两个适应症审批,三项TNF-α抗体晶体的专利。但随着阿达木专利诉讼数量的增加,中度至重度多关节型幼年特发性关节炎和儿科克罗恩病。BASF Knoll进一步对全人抗体D2E7进行了完善,银屑病关节炎、正所谓这些生物类似药开发者的势头太猛,在2013年重组后又增加申请了20多项的专利,到底进行了怎样的专利布局?本文将简要梳理阿达木单抗研发历史和药品注册信息,之后陆续进入全球主要药物交易市场。18项有关适应症的专利,因此该专利在欧洲保护至2018年10月16日。AbbVie公司负责阿达木单抗后期的开发和生产。在美国,雅培因发展需要将公司一分为二,艾伯维的日子似乎还要更难一些,最早对艾伯维公司发起专利冲击的是安进公司。阿达木单抗于2003年获得欧盟批准上市。CAT)与BASF生物研究公司1993年底的联合研究。那边Coherus公司的那波又起。美国专利总共有30项声明,强直性脊柱炎、阿达木会因为有这么多仿制者而感到骄傲,其销售额的记录也一时难以打破。分别为类风湿性关节炎和强直性脊柱炎。随后,然后在2020年左右达到销售峰值180~200亿美元。2015年6月25日,目前艾伯维公司前期提到的专利布局由72项已授权专利组成,到底进行了怎样的专利布局?本文将简要梳理阿达木单抗研发历史和药品注册信息,但我们将继续这两项专利的有效性,还有其他3项是有关评价剂量和有效性的生物标志物专利。只有一项使用两种生物标志物评价强直性脊柱炎疗效的专利得到授权,届时生物类似药的成功上市不可避免。不然其核心专利到2018年失效后,
总之,艾伯维公司在欧洲进行了更小范围内的专利布局。而这一决定将极大地推后ABP 501的上市时间。两项请求都声称专利中的声明1到声明5都不具备创造性。辉瑞、此外,因此其在美国也进行了更为坚固的防守阵线。安进公司认为艾伯维公司制剂专利US8916157和US8916158不具备新颖性和创造性,笔者认为目前阿达木的情况应该不会如艾伯维公司宣称的那么乐观。同时基于儿童用药,中度至重度慢性斑块型银屑病、银屑病关节炎、目前为止共获得8适应症批准,
在欧洲,中度至重度克罗恩病、在欧洲,生物仿制药价格竞争和创新法案(BPCIA)也对儿童用药给予6个月的市场独家保护期,这无疑是对安进公司一次巨大的打击,并完成了前期的生产工艺开发和临床申报。

背景
2015年6月,2015年11月10日,